COVID-19 EMERGENCY
Webmaster
COVID-19 PROTOCOLO
PROTOCOLO PARA LA DETECCIÓN DE SARS-COV-2 MEDIANTE PRECIPITACIÓN DE ARN Y RT-Q-PCR
Versión SOP 1.3, 19 Abril 2020
I. Recogida de muestra
- La recogida de muestra se realizará con dos torundas con las que se realizarán un frotis nasofaríngeo y un frotis faríngeo, respectivamente.
- Ambas torundas se introducirán en el tubo colector donde habrá 2 mL de medio de cultivo DMEM, UTM o equivalente
- Tras cerrar el tubo este se limpiará externamente con una solución de lejía al 10%.
II. Inactivación de la muestra
(Tiempo aprox. 15-30 min)
- La inactivación de la muestra se llevará a cabo en el interior de la cabina de BS2 situada en el laboratorio con presión negativa o BS3.
- Antes de introducir el tubo con la/s torundas se volverá a limpiar exteriormente con la solución de lejía 10%.
- Se agitarán las torundas en el medio cultivo para asegurar la trasferencia de la muestra de la torunda al medio.
- Una vez en el interior de la cabina se tomará un volumen de 325 μl de muestra que se pasaran a un tubo de 1.5 ml que contenga el mismo volumen de tampón de lisis (COBAS omni lysis buffer, Ref. 06997538190 o o Viral Lysis Buffer, NZYTech, Ref. MB40801). Volumen final 650 μl.
- Finalmente se limpiarán de nuevo los tubos con lejía al 10% antes de sacarlos de la cabina.
III. Precipitación de RNA
(Tiempo aprox. 1h)
- Esterilizar la campana de BS2 20 min con luz UV.
- Centrifugar a 12.000 g durante 10 min a 4°C.
- Recuperar 600 µl de sobrenadante y transferirlo a un tubo de 1.5 ml que contenga 600 µl de isopropanol con 4 µl de glycoblue (Stock: 15 mg/ml; Uso: 50 µg/ml; Invitrogen #AM9515) frío (mantenido a -20°C).
- Mezclar por inversión e incubar 10 min en hielo.
- Centrifugar a 12.000 g durante 10 min a 4°C.
- Descartar el sobrenadante.
- Añadir 500 µl de etanol 75% frío (mantenido a -20°C).
- Centrifugar a 12.000 g durante 5 min a 4ºC.
- Eliminar el etanol y dejar secar el pellet al aire 5-10 min.
- Resuspender el pellet en 40 µl de H2O de calidad biología molecular (libre de DNAsas y RNAsas, no tratada con DEPC), calentar a 60ºC durante 5 min.
-
Pasar a una placa de 96 pocillos (nomenclatura placa: “fecha-inicialesoperador-PlacaNo”: 090420-DM-P1) poner un adhesivo para taparla y guardar a -80C si no se va a usar inmediatamente. Si se va a proceder directamente al montaje de la Q-PCR, mantener en hielo.
IV.Realización de la RT-Q-PCR por TaqMan en placas de 384 pocillos
(Tiempo aprox. 3h)
- Se utilizará el Master mix para Q-PCR one-step de NZYTech Speedy One-step RT-qPCR Probe Master Mix (2x, NZYTech #MB40503) y las Sondas TaqMan CDC 2019-nCoV RUO Kit (solo las sondas N1, N2 y RNAseP, CDC #225397445).
- El volumen final de la reacción será de 10 µl (8 µl mix TaqMan + 2 µl muestra RNA) para placas de 384 pocillos. El mix TaqMan se realizará de la siguiente manera (volúmenes por pocillo):
- 5µl NZY master mix (2x)
- 0.75 µl sonda
- 2.25 µl H2O libre de DNAsas y RNAsas, no tratada con DEPC
-
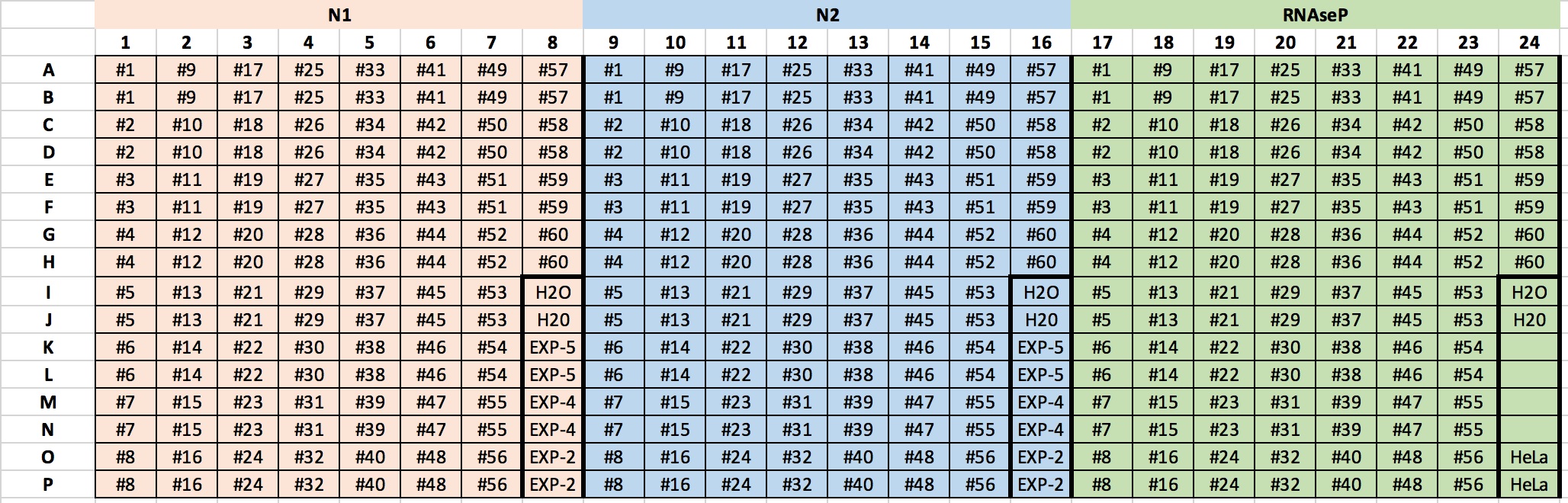
Además de las muestras a diagnosticar que se testarán en duplicado, se incorporarán los siguientes controles:
- NTC: Non template control - TaqMan mix + 2 µl H2O (libre de DNAsas y RNAsas, no tratada con DEPC)
- Control negativo: (RNA de HeLa o RNA de cualquier cultivo celular humano, no infectado)
- Control positivo: TaqMan mix + 2 µl de 2019-CoV Plásmido Control de CDC (200.000 copias/µl; CDC #225397446).
Diluciones: 10^-2, 10^-4, 10^-5 (4.000 – 40 – 4 copias por pocillo, respectivamente) para ver el límite de sensibilidad de las sondas para cada gen. Las diluciones se realizarán con H2O libre de DNAsas y RNAsas, no tratada con DEPC.
- Diseño y preparación de la placa
- Esterilizar la campana de BS2, 20 min con luz UV
- Para una placa de 60 muestras por duplicado + controles se prepararán tres mezclas,una para cada sonda (N1, N2 y RNaseP) con los siguientes volúmenes:
- 800 µl TaqMan Mix
- 120 µl sondas
-
360 µl H2O
- Si se va a pipetear con la multicanal, se pasan las mezclas a tiras de tubos de 8 (160 µl por tubo).
- Se añadirán 8 µl de la mezcla por pocillo.
- Posteriormente, se pipetearán 2 µl de la muestra o control por duplicado en los pocillos correspondientes, se tapará la placa con una tapa adhesiva (óptica compatible con el sistema de Q-PCR) y se centrifugará de nuevo.
- Se utilizará el siguiente programa de amplificación en un termociclador BioRad CFX384touch, utilizando el modo de threshold automático*:
| Ciclos | Temperatura | Tiempo | Reacción |
|---|---|---|---|
| 1 | 50°C | 20 min | Retrotranscripción |
| 1 | 95°C |
3 min |
Activación polimerasa |
| 40 | 95°C | 5 sec | Desnaturalización |
| 55°C | 50 sec | Hibridación + extensión |
* Aunque se ponga el modo de threshold y baseline automático, se revisarán las curvas antes de exportar los resultados por si existiera mucho background que pudiera distorsionar los resultados. Se modificará en caso de que fuera necesario.
- Exportación de los resultados:
- Siempre enviar los datos de la placa entera, aunque haya pocillos vacíos
- Enviar al grupo de análisis por email los siguientes archivos:
- El propio del software (*.pcrd)
- Tabla con valores Ct (Excel y csv)
V. Análisis de los resultados (criterios)
Este protocolo resume los criterios para interpretar los resultados de los controles y las muestras clínicas incluidas en el experimento de diagnóstico de COVID-19. Este criterio se ha adoptado durante la Fase 1 y se ha modificado de acuerdo con el protocolo publicado por el CDC.
Muestras: 60 muestras extraídas con el protocolo de precipitación por isopropanol.
Sondas: N1, N2, RNAseP
Controles:
- NTC: H2O (libre de DNAsas y RNAsas, no tratada con DEPC)
- Control Negativo: HeLa RNA (o RNA de cualquier cultivo celular humano, no infectado)
- Control Positivo: 2019-CoV Plásmido Control del CDC (200.000 copias/µl).
Diluciones: 10^-2 (en torno a las 1.000 que recomienda el CDC), 10^-4, 10^-5 (diluciones cerca del nuestro límite de detección (4.000 – 40 – 4 copias). Las diluciones se realizarán con H2O libre de DNAsas y RNAsas, no tratada con DEPC.
Control de Calidad:
- NTC (H2O) debe ser negativo para los 3 ensayos
- Todas las muestras clínicas y los controles negativos deben amplificar RNAseP a Ct <35
- El control positivo debe amplificar para los ensayos N1 y N2 para todas las diluciones (10^-2, 10^-4, 10^-5).
INTERPRETACIÓN DE RESULTADOS:
- Se utilizará como control para validar la integridad de la muestra el gen RNPase
- En caso de que RNPase salga a más de 35 ciclos (o indeterminada) rehacer con SYBR.
- Se considerarán positivas aquellas muestras que siendo positivas para RNPase (menos de 35 ciclos) tienen más de 4 copias en N1, en N2 o en ambos.
- Se consideran negativas aquellas muestras con más de 40 ciclos para ambos N1 y N2 (y RNPase con menos de 35 ciclos).
- Se consideran dudosas aquellas muestras con menos de 4 copias para ambos N1 y N2 (pero menos de 40 ciclos). Igualmente se considerarán dudosas, aquellas muestras en las que las réplicas técnicas sean incongruentes (una réplica con más de 4 copias, y la otra negativa (Ct>40)). En este caso, y si tras la revisión de las curvas de amplificación no fuera posible descartar un artefacto técnico, se procesarán las muestras con el método SYBR descrito en el apartado VI.
VI. Validación de muestras dudosas por RT-Q-PCR por SYBR
(Tiempo aprox. 3h)
Los casos dudosos se repetirán con SYBR Green, y el juego de cebadores del artículo de Won et al 2020.
- Se utilizará el Master Mix para NZYSpeedy One-step RT-qPCR Green Kit (NZYTech #MB34602) y los cebadores de Won et al 2020 (N1, E1, S1, RdRP y RPP30):
| Especie | Gen diana | Nombre cebador | Cebador Forward (5’-3’) | Cebador Reverse (5’-3’) |
|---|---|---|---|---|
| SARS-CoV-2 | RdRP | SARS-CoV- 2_IBS_RdRP1 | CATGTGTGGCGGTTCACTAT | TGCATTAACATTGGCCGTGA |
| S | SARS-CoV- 2_IBS_S1 | CTACATGCACCAGCAACTGT | CACCTGTGCCTGTTAAACCA | |
| N | SARS-CoV-2_IBS_N1 | CAATGCTGCAATCGTGCTAC | GTTGCGACTACGTGATGAGG | |
| Humano | RPP30 | IBS_RPP30 | CTATTAATGTGGCGATTGACCGA | TGAGGGCACTGGAAATTGTAT |
- El volumen final de la reacción será de 10 μL (8 μL mix SYBR Green+ 2 μL muestra RNA) para placas de 384 pocillos. La mezcla se realizará de la siguiente manera (volúmenes por pocillo):
- 5 μL SYBR Green Master Mix (2x)
- 1 μl mix cebadores directo y reverso (5mM)
- 0.4 μl NZYRT mix
- 1.6 μl de H2O libre de DNAsas y RNAsas, no tratada con DEPC
- Se añadirán 8 μl de la mezcla por pocillo
- Posteriormente, se pipetearán 2 μl de la muestra o control por duplicado en los pocillos correspondientes, se tapará la placa con una tapa adhesiva (óptica compatible con el sistema de Q-PCR) y se centrifugará de nuevo.
- 7.5 μL SYBR Green Master Mix (2x)
- 1.5 μl mix cebadores directo y reverso (5mM)
- 0.6 μl NZYRT mix
- 3.4 μl de H2O libre de DNAsas y RNAsas, no tratada con DEPC
- Se utilizará el siguiente programa de amplificación Life Technologies QS5 (Applied), utilizando el modo de threshold automático:
| Ciclos | Temperatura | Tiempo | Reacción |
|---|---|---|---|
| 1 | 50°C | 20 min | Retrotranscripción |
| 1 | 95°C | 3 min | Activación polimerasa |
| 40 | 95°C | 5 sec | Desnaturalización |
| 60°C | 50 sec | Hibridación + extensión |
- Además de las muestras a diagnosticar que se testarán en duplicado, se incorporarán los siguientes controles:
- NTC: Non template control - SYBR mix + 2 μl H2O (libre de DNAsas y RNAsas, no tratada con DEPC)
- Control negativo: (RNA de HeLa o RNA de cualquier cultivo celular humano, no infectado)
- Control positivo: 2019-CoV Plásmido Control de CDC (200.000 copias/μl).
Diluciones: 10^-2, 10^-3, 10^-4, 10^-5 (4.000 – 400 – 40 – 4 copias) para ver el límite de sensibilidad de los cebadores para cada gen. Las diluciones se realizarán con H2O libre de DNAsas y RNAsas, no tratada con DEPC.
- Exportación de los resultados:
- Siempre enviar los datos de la placa entera, aunque haya pocillos vacíos
- Enviar al grupo de análisis por email los siguientes archivos:
- El propio del software (*.pcrd)
- Tabla con valores Ct (Excel y csv)
Interpretación de resultados:
- Se analizarán los genes virales N, S y RdpP.
- Se utilizará como control para validar la integridad de la muestra el gen humano RPP30.
- Se considerarán positivas aquellas muestras en las que amplifiquen al menos dos de los tres genes virales y el gen RPP30 amplifique con menos de 35 ciclos.
- Se consideran negativas aquellas muestras en las que no amplifique ninguno de los tres genes (Ct>40) y el gen RPP30 amplifique con menos de 35 ciclos.
- Se considerarán indeterminadas aquellas que no pasen los criterios para ser definidas como negativas o positivas. Se recomendará la toma de una segunda muestra al cabo de unos pocos días.
- En caso de que RPP30 amplifique con más de 35 ciclos (o no amplifique; Ct>40) se REPETIRÁ la toma de la muestra, ya que se considera de calidad insuficiente para el análisis
