
Antropogenética
Práctica L4. Reacción en cadena de la polimerasa. Persistencia de la actividad lactasa
La lactosa es un disacárido compuesto por glucosa y galactosa que se encuentra fundamentalmente en la leche. Para que pueda ser asimilada por los mamíferos se precisa de su hidrólisis por la enzima lactasa (lactasa-florizin hidrolasa), que separa ambos monosacáridos. Este proceso se realiza en el borde ciliar de las células epiteliales del intestino.

Figura 1. La molécula de lactosa.
En la mayor parte de los seres humanos (y en prácticamente todos los mamíferos no humanos), la actividad lactasa intestinal decrece durante la infancia y adolescencia, hasta situarse entre un 5-10% de la actividad observada al nacimiento. Cuando esto ocurre, se dice que estas personas presentan hipolactasia (lactasa negativos). En otros individuos, la actividad de la enzima continúa a niveles altos durante la etapa adulta; estas personas muestran persistencia de actividad lactasa (lactasa positivos). La edad a la que comienza a decrecer la actividad lactasa es variable, pero nunca antes de los 2 años.
Los efectos de la ingestión de leche entre los individuos con baja actividad lactasa incluyen náuseas, flatulencias, diarreas y dolores abdominales. Estos síntomas se originan por la actividad de las bacterias del colon sobre la lactosa acumulada y no digerida. El hidrógeno que producen por su propia digestión, junto con la acidificación del contenido del colon por los ácidos grasos de cadena corta derivados, producen estas molestias. Su intensidad depende de la dosis, con un amplio rango de variabilidad individual. La dosis convencional utilizada en el test de tolerancia (50 g. de lactosa, equivalente al contenido de 1 litro de leche) produce síntomas en un 70 a 90% de los individuos con baja actividad lactasa, mientras que un vaso de leche los produce en tan sólo un 30 a 60% de los casos. La hipolactasia puede también afectar a la asimilación de otros componentes de la leche importantes en la dieta, como el calcio. Así, se ha observado una elevada proporción de lactasa negativos entre sujetos con osteoporosis, lo que se ha atribuido bien a una evitación del consumo de leche motivada por los síntomas descritos, o bien a un efecto negativo de la no absorción de la lactosa sobre la absorción del calcio.
La base molecular de la hipolactasia heredable parece ajustarse a un modelo autosómico recesivo. Sin embargo, no se han observado diferencias en la secuencia del gen entre individuos con persistencia e individuos sin persistencia. De acuerdo con algunas observaciones, el declive de la lactasa intestinal lo determinaría una secuencia reguladora, en 2q21, dentro de cuya región se han encontrado algunas variantes asociadas a la condición persistencia/no persistencia y con una distribución geográfica desigual.
Figura 2. Ubicación
del gen de la
lactasa, su gen vecino, MCM6 y algunas posiciones diagnósticas del
carácter
persistencia en su secuencia reguladora.
Los individuos lactasa negativos son mayoritarios en nuestra especie, pero hay algunas poblaciones, como las que pueblan el Centro y Norte de Europa, y algunos grupos nómadas del Norte de Africa y Próximo y Medio Oriente en las que predominan los individuos con persistencia de actividad lactasa. En una parte importante de los casos, las frecuencias altas de lactasa positivos se asocian con poblaciones que a lo largo de su historia han mantenido unas tasas elevadas de producción y consumo de leche. Para numerosos investigadores, el alelo responsable de la persistencia habrá alcanzado altas frecuencias por selección natural desde el Neolítico en aquellas poblaciones que han mantenido prácticas continuadas de pastoreo. Según esta hipótesis, en el Paleolítico la actividad lactasa disminuiría en todos los individuos después de la lactancia; con la aparición de animales domésticos productores de leche el alelo mutante que codifica para la persistencia de actividad lactasa produciría una ventaja selectiva, aumentando la disponibilidad de calorías y nutrientes, particularmente calcio, a través de la leche. Esta ventaja se manifestaría especialmente en poblaciones con pastoreo en condiciones nutritivas límite.
En todo caso, la acción de la selección puede explicar de un modo sencillo las elevadas frecuencias de persistencia observadas en poblaciones nómadas del Norte de Africa y Próximo Oriente. Más difíciles de aclarar son las causas por las que se observan también altas frecuencias en poblaciones del Centro y Norte de Europa. En Escandinavia, donde se observan los valores más altos, la agricultura y la ganadería se introdujeron relativamente tarde, no antes de hace 4.000 años y su economía no ha sido particularmente dependiente de prácticas de pastoreo y producción de leche.
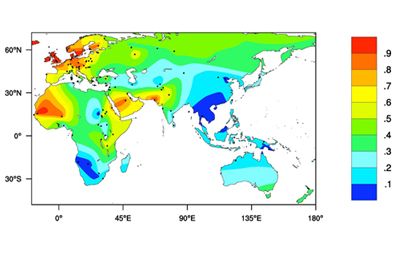
Figura 3.
Frecuencias de persistencia
de actividad lactasa.
En esta práctica se va a amplificar un fragmento de 383 pares de
bases, que incluye los SNPs diagnósticos -14010, -13915, -13910 y
-13907. De ellos, -13910 es característico de Europa y los otros de
África.
Los oligonucleótidos utilizados serán:
5'-GAATGCTCATACGACCATGGAA-3'
5'-CTGCTTTGGTTGAAGCGAAG-3'
Y la secuencia amplificada será:
1 ctgctttggt tgaagcgaag atgggacgct tgaatgccct ttcgtactac tcccctttta
61
cctcgttaat acccactgac ctatcctcgt ggaatgcagg gctcaaagaa caatctaaaa
121
atcaaacatt atacaaatgc aacctaagga ggagagttcc tttgaggcca ggggctacat
181
tatcttatct gtattgccag cgcagaggcc tactagtaca ttgtagggtc taagtacatt
241
tttcctgaat gaaaggtatt aaatggtaac ttacgtcttt
atgcactcta taaactatga
301
cgtgatcgtc tccgtctaac aactacactc aaatgcttac caagctcttt aaagggaaga
361
attccatggt cgtatgagca ttc
Preparación de la solución PCR.
1. Se rotula un tubo de 0,5 ml. en el que se preparará la solución PCR para varias muestras. |
 |
2. Se rotulan los tubos PCR de 0,2 ml. en los que se llevarán a cabo las reacciones. |
 |
3. En cada tubo PCR de 0,2 ml. se añaden 6 µl de ADN.
4. En el tubo de 0,5 ml. se prepara la solución mix-PCR. Para ello, se
añaden:
| |
Reactivo
|
1 muestra
|
|
1
|
H2O
|
8 µl
|
|
2
|
Master mix
|
15 µl
|
|
3
|
Cebador F
|
0,5 µl
|
|
4
|
Cebador R
|
0,5 µl
|
El volumen total será, por tanto, de 30 µl (24 de mix y 6 de ADN).
5. Agitar bien la solución.
6. Añadir 27 µl. de solución a cada tubo PCR de 0,2 ml.
7. Llevar rapidamente al termociclador.
Programación del termociclador.
El programa PCR es el siguiente:
|
Temperatura
|
Tiempo
|
Repeticiones
|
|
94ºC
|
5 min.
|
|
|
94ºC
|
30 s.
|
X35
|
|
58ºC
|
30 s.
|
X35
|
|
72ºC
|
75 s.
|
X35
|
|
72ºC
|
10 min.
|
|
|
4 ºC
|
indefinido
|
|
| Se disponen los tubos con las muestras en el termociclador y se ejecuta el programa PCR. |  |
| Una vez terminado el programa, se conservan los amplificados a 4ºC hasta su visualización. |  |
@Jose A. Peña, Mikel Iriondo, 2024 Universidad del País Vasco (UPV/EHU)