|
1.- Primera técnica: la difracción de rayos X |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
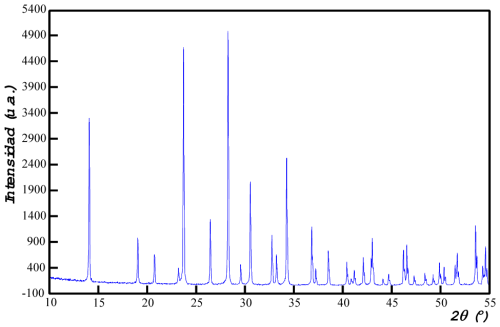
Una vez realizado el difractograma del precipitado obtenido, procederemos a asignar índices de Miller (hkl) a los distintos máximos de difracción, con el fin de conocer su posible sistema cristalino y los parámetros de celda con los que cristaliza. Esta indexación la realizamos siguiendo la metodología descrita en el sitio de Internet "Identificación de materiales Cristalinos. Práctica guiada". También puede accederse a la citada práctica a traves de la página principal del grupo de investigación IMaCris/MaCrisI.
Tras realizar el proceso de caracterización completo, llegamos a la conclusión de que la fase es cristalina (presenta máximos de difracción), y que el sistema cristalino más probable en el que cristaliza es el sistema trigonal, con parámetros de celda:
[Arriba] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2.- Segunda técnica: el análisis químico |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
A partir de los porcentajes de elementos químicos presentes en nuestra muestra que proporcionan el análisis elemental y el EOA se obtiene información sobre su fórmula atómica. Los resultados han suministrado los siguientes datos analíticos:
Como podemos observar en la tabla, los porcentajes de C y N son muy bajos. Por este motivo podemos considerar que no existen cantidades significativas de estos elementos en nuestra muestra. Además, hay que tener en cuenta que en la síntesis realizada no hemos utilizado ningún reactivo que contenga estos elementos, por lo que es lógico pensar que el producto final no contenga carbono y tampoco nitrógeno. Dado que no hemos obtenido datos sobre la cantidad de oxígeno, lo estimaremos como la diferencia al 100% de la suma de los porcentajes obtenidos para el resto de los elementos. Los cálculos conducen a la siguiente tabla (para más detalles sobre los cálculos, visita el apartado correspondiente al Análisis Químico):
En la tabla anterior, la columna 6 se obtiene multiplicando la columna 5 por un factor 2, con el fin de que las relaciones atómicas sean números enteros. Por lo tanto, en la fase obtenida de la síntesis las relaciones atómicas son: H : Fe : Se : O Þ 6 : 2 : 3 : 12 Y su fórmula más probable sería: H6Fe2Se3O12 Recordemos que el objetivo de nuestra síntesis es la obtención de un selenito de hierro(III). Teniendo en cuenta que el grupo selenito es (SeO3), parece lógico pensar que hay tres grupos selenito por fórmula, ya que hay tres selenios en nuestra fórmula más probable: (SeO3)3. Esto supone un total de 9 oxígenos. Los tres oxígenos restantes (hasta un total de 12) y los seis átomos de hidrógeno podrían formar parte de tres moléculas de agua, (H2O)3. A la vista de estas agrupaciones, podemos proponer la siguiente fórmula química para nuestro producto de síntesis:
Fe2(SeO3)3(H2O)3 A continuación vamos a intentar comprobar si la fase obtenida presenta la fórmula propuesta. [Arriba] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
3.- Tercera técnica: Espectroscopia Infrarroja |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
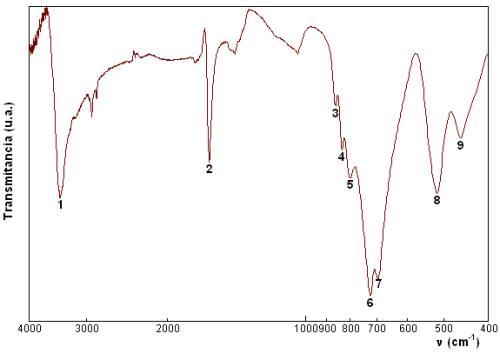
Considerando la fórmula propuesta anteriormente para nuestra fase, Fe2(SeO3)3(H2O)3, las bandas de absorción que debemos observar en el espectro de infrarrojo son las que se muestran en la siguiente tabla:
El espectro de infrarrojo del producto de la síntesis muestra las siguientes bandas de absorción, numeradas de 1 al 9:
La lectura de la posición y la asignación de las bandas a los diferentes modos de vibración, teniendo en cuenta la tabla anterior, se puede realizar de la forma que se presenta a continuación:
Mediante espectroscopía IR confirmamos que la fase producto de la síntesis posee las bandas correspondientes a los enlaces Se-O y O-H. Podría tratarse, por tanto, de un selenito que contiene una o varias moléculas de agua, tal como se ha propuesto al considerar la fórmula Fe2(SeO3)3(H2O)3. [Arriba] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4.- Cuarta técnica: Análisis Termogravimétrico |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Se ha realizado una termogravimetría (TG) de la fase a caracterizar, desde temperatura ambiente hasta 800ºC, en atmósfera de aire y con una velocidad de calentamiento de 5 ºC por minuto. El resultado obtenido es el siguiente:
En la curva TG se aprecian dos intervalos de pérdida de masa significativamente diferentes, marcados en la figura como los números [1] y [2]. La primera pérdida de masa [1] tiene lugar en el intervalo comprendido entre 25 y 350 ºC. Se pierde un 11 % de la masa inicial. Dado que hemos propuesto para nuestro compuesto una fórmula hidratada, cabe esperar que durante esta primera etapa se pierda la masa correspondiente a las moléculas de agua. Para comprobarlo calculamos el porcentaje en peso correspondiente a las tres moléculas de H2O en la fórmula del compuesto. % H2Oteórico = (Pm (H20)3 / Pmcompuesto) * 100 % H2Oteórico = (3*18 g mol-1 / 546.61 g mol-1) * 100 = 9.9% El resultado obtenido está en buen acuerdo con el porcentaje masa que se pierde en el intervalo [1], un 11%. Por lo tanto, podemos concluir que esta primera pérdida se debe a la eliminación de las tres moléculas de agua del compuesto. Entre 350 ºC y 570 ºC tiene lugar la segunda pérdida de masa [2], correspondiente a un 61% de la masa total. Esta segunda pérdida corresponde a la destrucción de la estructura de la fase como consecuencia de la descomposición térmica de los grupos selenito en forma de Se y de O2 gaseosos (generalmente representado por el símbolo ). Como resultado de esta descomposición, el residuo debería estar formado por un óxido de hierro. En consecuencia, la relación propuesta para describir la descomposición de este compuesto es la siguiente: Fe2(SeO3)3·(H2O)3 Þ 3H2O [1] + 3Se [2] + 3O2 [2] + Fe2O3 [residuo] Comprobamos que la pérdida de 3Se [2] y de 3O2 [2] corresponde al 61% de la masa total. % pérdidateórico = ( Pm (3Se+3O2) / Pmcompuesto ) * 100 % pérdidateórico = ( (3*78.96 g mol-1 + 3*32 g mol-1) / 546.61 g mol-1 ) * 100 = 60.9% [Arriba] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
5.- Quinta técnica: Difracción de rayos X y Termodifractometría |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
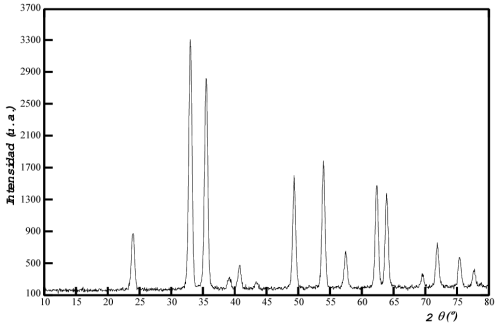
El residuo final obtenido tras el análisis termogravimétrico ha sido
caracterizado mediante difracción de rayos X en muestra policristalina.
Presenta un difractograma con máximos de difracción bien definidos, por lo
que se puede abordar la identificación de dicho residuo:
Los 15 máximos de difracción que aparecen en el difractograma se sitúan en las posiciones angulares y presentan las intensidades relativas que se recogen en la siguiente tabla:
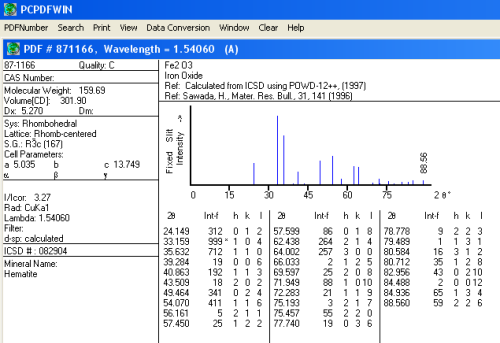
La caracterización de este residuo se ha realizado utilizando la base de datos PDF (ver "Identificación de Materiales Cristalinos. Práctica guiada"). Ello ha permitido confirmar que se trata de un óxido de hierro(III), de fórmula igual a la propuesta para el residuo, Fe2O3, que cristaliza en el sistema trigonal. A continuación se reproduce la ficha PDF correspondiente a este óxido de hierro:
Como es lógico, podemos utilizar la termodifractometría para conocer los intervalos de estabilidad térmica de las estructuras cristalinas de las diferentes fases presentes durante el proceso de descomposición de un material. A continuación se representa la TDX de nuestro producto de síntesis:
En él se puede apreciar que existen tres etapas claras durante la descomposición térmica de nuestro selenito de hierro hidratado, correlacionables con los observados en el análisis termogravimétrico:
[Arriba] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
6.- Conclusión |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Utilizando las técnicas de difracción de rayos X, espectroscopia IR y análisis TG, podemos corroborar que la fase sintetizada es cristalina, y que la fórmula que hemos propuesto con los datos de análisis químico es la correcta, Fe2(SeO3)3(H2O)3. Además, mediante TG y análisis TDX hemos puesto de manifiesto que durante la descomposición térmica la estructura cristalina se destruye (a 300ºC), formándose un compuesto amorfo que, tras alcanzar los 450ºC, cristaliza como Fe2O3.
|