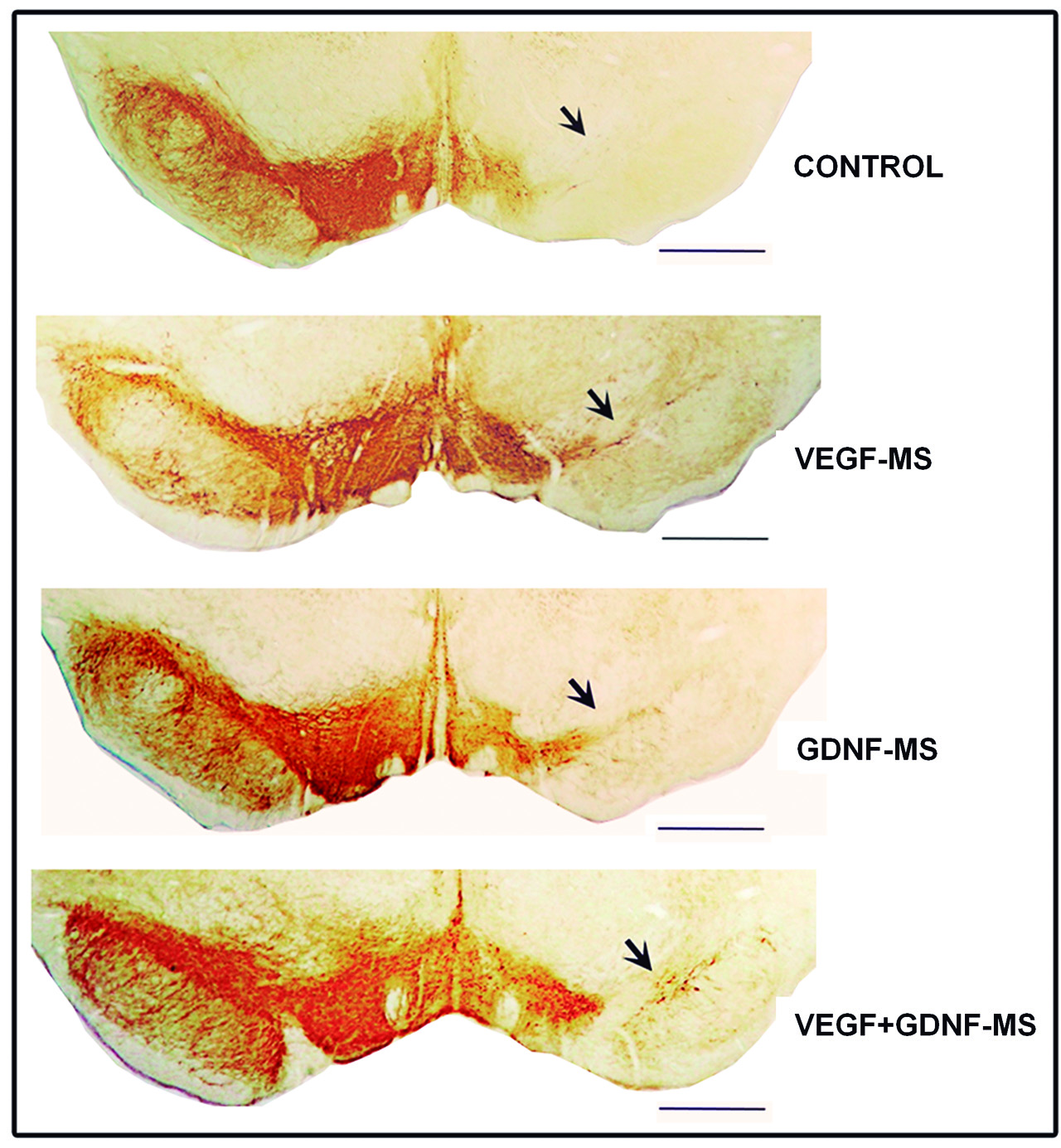
La enfermedad de Parkinson es la segunda patología neurodegenerativa más común en la actualidad. Las terapias actuales son principalmente sustitutivas y presentan problemas a largo plazo, por lo que el reto está en hacer un diagnóstico temprano y desarrollar terapias neuroprotectoras y neurorrestauradoras que permitan ralentizar o incluso revertir los síntomas de la enfermedad Trabajos realizados por el grupo LaNCE del Departamento de Neurociencias de la Facultad de Medicina y Enfermería, dentro de la tesis doctoral de Catalina Requejo, y en los que han intervenido los grupos de Neurofarmacología de la Facultad de Medicina y Enfermería y NanoBiocel de la Facultad de Farmacia, han documentado el efecto regenerador y neuroprotector de dos factores neurotróficos cuando se aplican de forma combinada.
-

Graduación de la tercera promoción del programa ‘Erasmus Mundus Joint Master Degree in Enviromental Contamination and Toxicology ECT+’
-

Primera promoción del Grado en Inteligencia Artificial
-

La UPV/EHU presenta sus monoplazas de Formula Student en el Reino Unido
-

Gure babeslerik onena
-

Nueva tecnología low cost para evitar la colisión entre drones
La combinación de dos proteínas tiene un efecto regenerador y neuroprotector en el Parkinson
Según la investigación de la UPV/EHU, la sinergia de los dos factores neurotróficos resultaría beneficiosa sobre todo en una fase temprana de la enfermedad
- Investigación
Fecha de primera publicación: 02/01/2018

El Parkinson a un trastorno motor, originado por la pérdida de neuronas dopaminérgicas en la sustancia negra del cerebro. Estas neuronas son las células nerviosas que producen dopamina, un neurotransmisor que tiene un papel central en la modulación de los movimientos involuntarios.
La investigación llevada a cabo en la UPV/EHU se ha desarrollado en un modelo experimental que permite reproducir diferentes estadios de la enfermedad de Parkinson. Los resultados mostraron que los cambios provocados por la dolencia no eran homogéneos en las diferentes regiones del cerebro afectadas. “La afectación se corresponde con la distribución anatómica específica de las neuronas dopaminérgicas y sus terminales”, indica la investigadora Catalina Requejo. Es decir, aquellas zonas de la sustancia negra en las que las neuronas dopaminérgicas tienen más conexiones con regiones que se mantienen íntegras se veían menos afectadas.
Tras confirmar que el modelo experimental servía para explorar los cambios morfológicos y funcionales que provoca la enfermedad, se aplicaron estrategias terapéuticas basadas en la liberación de factores neurotróficos. Estos factores son proteínas que favorecen el crecimiento, la plasticidad y la supervivencia celular y juegan, por tanto, un papel fundamental en la regulación de la función neuronal.
En concreto, se aplicaron dos factores: el factor de crecimiento del endotelio vascular (VEGF) y el factor derivado de las células gliales (GDNF). Estas moléculas se administraron embebidas en microesferas o en nanoesferas, más pequeñas aún que las anteriores, de un polímero biocompatible y biodegradable como es el ácido poli-láctico-co-glicólico (PLAG), lo cual permite su liberación de forma continua y gradual. Además, administraron los factores de manera combinada para determinar si juntos inducían un efecto sinérgico.
Tanto en la fase temprana como en la severa del modelo, los resultados fueron alentadores. La combinación del VEGF y GDNF no solo redujo significativamente la degeneración en las neuronas dopaminérgicas de la sustancia negra, sino que también indujo la formación de nuevas células y la diferenciación celular. Además, pudieron comprobar que había una mejora en las áreas donde proyectaban las fibras nerviosas de esta región. Para confirmar el efecto sinérgico y neurorregenerador de ambos factores, administraron una molécula que inhibe los receptores de los dos factores neurotróficos que estaban estudiando. “Las consecuencias sobre el sistema dopaminérgico eran aún peores, lo cual apoya los efectos beneficiosos y sinérgicos que ejercen el VEGF y el GDNF en la enfermedad de Parkinson”, concluye la investigadora.
Por último, cabe destacar que los mejores resultados se obtuvieron cuando se administraron los factores embebidos en nanoesferas durante la fase temprana de la enfermedad replicada en el modelo. Todo ello refuerza la importancia del diagnóstico precoz y que “la nanotecnología podría ser una herramienta muy útil a la hora de administrar factores neurotróficos”, añade.
Información complementaria
Estos trabajos, publicados en la prestigiosa revista científica Molecular Neurobiology, son el resultado de la tesis doctoral de Catalina Requejo. Licenciada en Biología por la UPV/EHU, realizó el doctorado con mención internacional en Neurociencias con la calificación de sobresaliente Cum laude en 2015. Su tesis doctoral, dirigida por José Vicente Lafuente, abordó el análisis morfo-funcional de los cambios que presenta un modelo experimental de Parkinson y los efectos de la administración de factores neurotróficos en dicho modelo. Tras una estancia predoctoral de 3 meses en Harvard Medical School en Boston, ha recibido una beca posdoctoral de dos años en el hospital Mount Sinai de Nueva York, donde llevará a cabo un estudio sobre los mecanismos moleculares y celulares implicados en la activación de la autofagia para la degradación de sinucleína.
Referencia bibliográfica
- Nanoformulation: A Useful Therapeutic Strategy for Improving Neuroprotection and the Neurorestorative Potential in Experimental Models of Parkinson's Disease.
- Int Rev Neurobiol; 137:99-122.
- DOI: 10.1016/bs.irn.2017.09.003